Защитимся от коррозии
Срок службы кузова и деталей подвески автомобиля в городских условиях весьма невелик - загазованность воздуха и использование на дороге различных химических реактивов приводит к значительным коррозионным разрушениям уже через три-четыре года (в сельской местности скорость коррозионного разрушения в 5...6 раз меньше).
В благополучной Америке выяснили, что в год затраты на борьбу с коррозией составляют 0,5%...1% от первоначальной стоимости автомобиля.
Отметим, что отечественные автомобили по защищенности от коррозии уступают импортным, что в сочетании с более тяжелыми условиями эксплуатации и низким уровнем обслуживания еще сокращает срок жизни отечественных автомобилей и увеличивает затраты на предотвращение коррозионного разрушения.
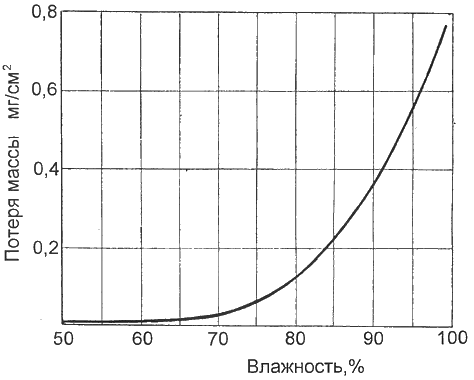
Рис. 1. Зависимость скорости атмосферной коррозии железа (потеря массы в сутки) от влажности воздуха
Очень большое влияние на развитие коррозионных процессов оказывают влажность воздуха и суточный перепад температур. Так, при влажности воздуха, превышающей 70%, скорость коррозии резко возрастает (рис. 1). Это происходит потому, что даже небольшого суточного перепада температур в 4...5°С достаточно для образования конденсата. Активнее всего конденсат из-за колебания температуры появляется в плохо вентилируемом гараже.
Конденсат, образующийся на поверхностях деталей и скапливающийся в скрытых полостях и щелях кузова автомобиля, является электролитом, то есть обладает электропроводимостью. В среде электролита металлы образуют гальванические пары в соответствии с электродными потенциалами металлов. Кстати, для образования гальванической пары даже не требуется присутствия двух металлов, так как для этого достаточно даже небольшой разницы в химическом составе отдельных участков изделия из одного металла.
Большую роль в коррозионных процессах играют химические средства, используемые зимой для борьбы с обледенением на дорогах. Немецкие исследователи выяснили, что в результате воздействия солеи, используемых зимой в городах, скорость коррозии увеличивается примерно в два раза.
Ниже приведены значения стандартных электрических потенциалов (в вольтах) некоторых металлов (ряд металлов, выстроенных в порядке возрастания их стандартных электродных потенциалов, называется еще рядом активностей, или рядом напряжений):
| Магний | Алюминий | Хром | Цинк | Железо | Никель | Свинец | Медь |
| -2,38 | -1,66 | -0,91 | -0,76 | -0,44 | -0,24 | -0,13 | +0,34 |
Металлы, образующие гальваническую пару в среде электролита, подразделяют следующим образом: более электроотрицательный называют анодом, менее электроотрицательный - катодом. Понятно, металл на аноде обладает более высокой способностью отдавать электроны, так что анод в результате электрохимических превращений окисляется с образованием окислов и гидроокислов металла, то есть осуществляется его коррозионное разрушение, в то время как металл катода не разрушается.
Таким образом, магний, алюминий, хром и цинк по отношению к железу (стали) являются анодами, а само железо по отношению к ним - катодом. И наоборот, железо является анодом, по отношению к никелю, свинцу и меди. Поэтому при контакте железа с цинком в присутствии электролита окисляется цинк, а в паре сталь-медь разрушается (окисляется) сталь.
Для предотвращения разрушения металла автомобиля от коррозии используют два принципиально различных метода: либо устраняют контакт металла с пленкой образующегося на его поверхности электролита, образовав на металле непроницаемые для воды покрытие (краска, мастика), либо изменяют электрический потенциал защищаемого металла. И если первый метод защиты от коррозии не требует особых пояснений, то со вторым разберемся подробнее.
Так, при протекторной защите предохраняемому металлу придают "статус" катода, прибегая к помощи более активного металла. Из приведенного выше ряда напряжении видно, что по отношению к железу более активными являются цинк, хром, алюминий и магний, и, следовательно, в качестве протектора, принимающего на себя все атаки коррозии, теоретически могут быть использованы эти металлы. Практически же хром и алюминий для этой цели непригодны, так как покрыты очень прочными и плотными окисными пленками, в результате остаются только цинк или магний. Но последний слишком активен, окисная пленка у него настолько непрочная, что металл легко окисляется на воздухе. То есть выбор металла для протекторной защиты железа практически ограничивается цинком. Организуют протекторную защиту, укрепив на поверхности защищаемого металла пластины из цинка. А лучше на поверхность нанести слой металла-протектора. Электроны протектора будут переходить в защищаемый металл, в результате на металле корпуса автомобиля (на катоде) станет выделяться водород, который способен даже восстановить часть образовавшейся ржавчины. Металл протектора, теряя электроны, начнет реагировать с кислородом с образованием гидрата окиси цинка. И продолжаться этот процесс защиты основного металла будет до тех пор, пока протектор не разрушится полностью. Описана, естественно, несколько идеализированная ситуация, поскольку в реальности к процессу образования гидроокиси добавляются процессы химического взаимодействия металла протектора и его гидроокиси с химическими соединениями, присутствующими в слое электролита на поверхности защищаемого металла.
Учтите, протекторная защита с размещением на стальном кузове отдельных накладок из цинка эффективна только в ограниченной зоне установки протектора. Кроме того, подобный метод защиты имеет существенный недостаток, связанный с преимущественной коррозией протектора в месте его установки на кузове, что обычно сопровождается быстрым нарушением электрического контакта между протектором и кузовом в точке крепления.
При полной протекторной защите автомобиля осуществляется хромирование бамперов и элементов оформления, а детали кузова выполняют из оцинкованного листа (при изготовлении кузова из стали с цинковым покрытием толщиной всего 0,09 мм срок его службы увеличивается на 4 года и более).
Достаточно эффективную местную протекторную защиту не очень сложно осуществить и самому путем нанесения слоя цинка на поверхности той или иной стальной детали способом электролитического осаждения. Так, этим способом удобнее всего защищать наиболее подверженные воздействию влаги детали подвески и ходовой части автомобиля.
Делают это так. Сначала соответствующие места этих деталей тщательно зачищают наждачной бумагой до основного металла. Далее готовят раствор хлористого цинка в соляной кислоте, для чего добавляют в кислоту металлический цинк до тех пор, пока в растворе не прекратится процесс образования водорода. Наличие в растворе мути и твердых частиц не мешают его использованию. В качестве источника цинка подойдут корпуса отслуживших свой срок батареек от бытовой техники (учтите, в современных батарейках цинк прячут под наружным декоративным корпусом).
Электрическая цепь для проведения процесса электролитического осаждения цинка приведена на рис. 2. Состоит эта цепь из автомобильного аккумулятора, автомобильной лампочки мощностью 15...21 Вт и цинкового наконечника. Обязательно обеспечить надежность соединения выбранной вами детали с массой автомобиля! На рис. 2 не зря показана задняя подвеска переднеприводного автомобиля - именно такие узлы, соединяемые с кузовом посредством резинометаллических втулок (сайлент-блоков), зачастую не имеют надежного электрического контакта с кузовом (то есть и с аккумулятором). Поэтому балку задней подвески необходимо соединить с массовой клеммой аккумулятора отдельным проводом. Автор много лет назад столкнулся с подобным отсутствием контакта с массой при попытке нанесения протекторного покрытия на рычаги задней подвески автомобиля "Запорожец".
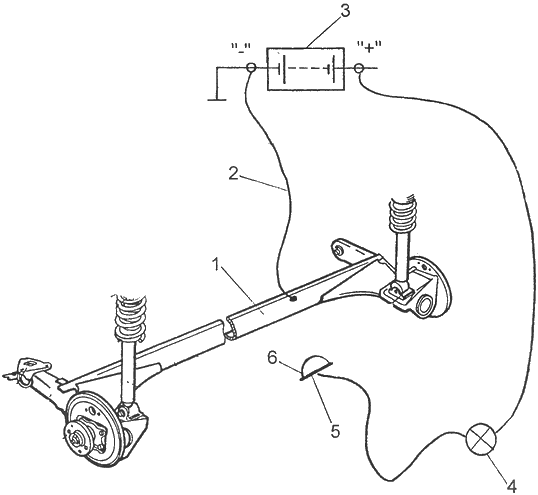
Рис. 2. Электрическая схема для электролитического нанесения цинкового покрытия: 1 - защищаемый элемент кузова или подвески (в данном случае задняя балка BA3-2108); 2 - дополнительный провод соединения детали с массой; 3 - аккумулятор; 4 - автомобильная 12-вольтовая лампа мощностью 15...21 Вт; 5 - цинковая пластина; 6 - тампон
Но вернемся к технике нанесения покрытия из цинка на стальную деталь. Цинковый наконечник, припаянный к проводу от лампочки, обертываем тампоном и пропитываем приготовленным раствором хлористого цинка. Тампон - одноразовый, поэтому не обязательно использовать для него кислотостойкий материал. Годится обычная вата, завернутая в хлопчатобумажную ткань, или кусок поролона (поролон подходит не всякий, так как некоторые его виды способны под действием раствора хлористого цинка развалиться прямо у вас в руках). Этим тампоном медленно водим по зачищенному участку металла (обязательно работать в резиновых перчатках). Смоченный раствором хлористого цинка тампон замыкает электрическую цепь, в результате чего ток, проходящий от положительной клеммы аккумулятора через лампочку на массу (корпус), обеспечивая осаждение на подготовленной поверхности слоя цинка. Тампон по поверхности детали перемещают медленно, периодически обновляя раствор на тампоне и не давая тампону чересчур нагреваться. Дело в том, что излишний нагрев тампона свидетельствует об излишне большой силе тока (в этом случае включают в цепь лампочку меньшей мощности), что ухудшает сцепление наносимого слоя с основным металлом. Продолжительность процесса зависит от площади наносимого слоя цинка и от толщины слоя, которую необходимо достичь. Обычно время процесса составляет от одной до нескольких минут. Чем больше толщина протекторного слоя, тем лучше. Попутно заметим, что наносить слой цинка следует не на середину балки, как можно понять из рис. 2, а на места сварки балки с рычагами задней подвески.
После окончания процесса нанесения слоя цинка обязательно тщательно промойте покрытие водой, чтобы устранить остатки раствора хлористого цинка и соляной кислоты.
Обратите внимание, что слой цинка защищает от коррозии не только находящуюся под ним поверхность, но и некоторую зону вокруг себя, причем если деталь (узел) в этой зоне имеет сквозные проемы, то от коррозии защищается в определенной мере также и оборотная сторона детали. Это удобно при защите различных штампованных деталей, рычагов и профилей.
Описанный метод нанесения защитного протекторного цинкового покрытия по эффективности ничуть не уступает рекламируемому методу электрохимической защиты с посторонним источником напряжения и наклеиваемыми на кузов электродами (анодами). Более того, нанести цинковое защитное покрытие удается даже в тех местах, где закрепление защитных электродов с проводами просто нереально, например, на уже упомянутых деталях подвески, не имеющих, кстати, надежного электрического контакта с кузовом.
Использование же для изменения потенциала защищаемого металла постороннего источника тока наиболее эффективно для предотвращения коррозионного разрушения автомобиля в столь расплодившихся сейчас "ракушках".
Однако при всем разнообразии методов и средств наиболее надежным способом общей защиты автомобиля от коррозии является использование комбинации из нескольких методов защиты.
Так, даже применяя надежные современные мастики, трудно гарантировать отсутствие в пленке трещин. Кроме того, мастика может просто отслоиться от поверхности металла. Подобного нарушения сплошности покрытия (иногда скрытного) бывает достаточно для активной коррозии металла. Именно поэтому рекомендуется использовать грунтовки с протекторным наполнением. Конечно, и цинкование опасных зон тоже весьма эффективно. А объемная защита всего автомобиля в гараже "ракушке" достигается созданием защитного потенциала между автомобилем и корпусом укрытия.

«Так, при протекторной защите предохраняемому металлу придают «статус» катода, прибегая к помощи более активного металла. Из приведенного выше ряда напряжении видно, что по отношению к железу более активными являются цинк, хром, алюминий и магний»
А теперь вопрос: почему у меня на лодочном моторе Ямаха стоит и разрушается протектор из цинка, тогда как из вашей таблицы разрушаться должна нога двигателя. Ибо она из алюминия, который в таблице стоит правее цинка. А стало быть Алюминий должен быть анодом для цинка. На деле все наоборот.
Прошу прощения. Алюминий стоит «левее» цинка. Он электрически активней и должен разрушаться. На деле, как я писал, все происходит наоборот. И еще вопрос: Имеем катер из алюмине-магниевого сплава. Это металлы левостоящие по отношению ко всем другим. Чем, каким протектором их можно уберечь от коррозии?
Спасибо.